投资界(微信ID:pedaily)4月12日获悉,广州市康立明生物科技有限责任公司正式宣布完成3亿元人民币B轮融资,由鼎晖投资、IDG资本投资,原股东辰德资本和金阖、金垣基金继续跟投。
时隔一年半再获融资,这在康立明生物创始人邹鸿志看来,是“水到渠成的事”。2015年成立,康立明生物主攻一款用粪便DNA进行肠癌早期检测的试剂盒的研发,命名“长安心”。终于,2018年11月20日,这款拳头产品获得国家药品监督管理局(NMPA)批准上市,成为国内首个拥有注册证销售的粪便DNA肠癌检测产品。
对康立明生物来说,这无疑是一个重大里程碑事件。而对中国的医生和患者而言,“长安心”的出现,又为肠癌的早期诊断打开了另一扇门。
归国创业,始于一篇“命题作文”
或许连邹鸿志自己也没想到,17年前的一个概念、一篇命题作文,变成了今日沉甸甸的果实,而他正是把作文写完的那个人。
外科医生出身,2002年从上海交通大学医学院博士毕业后,邹鸿志远赴美国,在世界知名的梅奥医学中心(Mayo Clinic)胃肠科从事博士后研究工作,后担任该机构个体化治疗中心高级副主任。
彼时,已经在纳斯达克上市的美国分子诊断公司Exact Sciences遭遇危机,亟需有爆发力的产品填充,邹鸿志随即被聘往Exact Science任技术总监,负责一款新产品的研发。“我们想重新复活这家公司。”邹鸿志对投资界说道。
而正是这款新产品——ColoGuard粪便肠癌筛查试剂盒的开发,成为邹鸿志在美国数年,最具标志性的一项工作。
2014年8月,ColoGuard获得美国食品药品管理局(FDA)批准临床使用,被认为是分子诊断领域近十年来最大的突破,这也是美国FDA批准唯一的肠癌无创粪便检测技术。这种肠癌筛查方法后来被纳入美国肠癌筛查指南,作为标准方法推荐使用。
ColoGuard上市后得到了很好的市场反馈,不管是临床还是监管部门,都对其高度认可。据外媒报道,这款产品的敏感度比免疫化学法便潜血筛查的敏感度提高了10-20%左右,对结直肠癌的敏感度高达92%,大大降低了美国肠癌发病率,其售价约600美元。而Exact Sciences的市值也凭借这款产品在纳斯达克市场上快速攀升超过百亿美元,成为美国资本市场上体外诊断领域的标杆性企业之一。
但令人讶异的是,邹鸿志并没有在Exact Sciences继续其他产品的开发工作。早在2012年ColoGuard开发完成后,他就离开公司,成立了自己的实验室。同时,他在中山大学的邀请下担任兼职教授,并担任广东省胃肠病学研究所副所长。
频繁往来于中美之间,他发现,中国结直肠癌已成为多发癌肿,每年发病率都在上升。与此同时,国内肠癌筛查手段又相对传统,用粪便筛查癌症,这在中国大众认知里几乎不可想象。
面对这一窘境,邹鸿志心生回国的念头。他决定重新开发一款针对中国人的结直肠癌检测产品,还要提高性价比。2015年,邹鸿志在广州创办康立明,潜心研发“长安心”。短短三年时间,这一重磅产品便研发成功获批上市。
检测肠癌,只有一个快递的距离
肠癌,已成为中国发病率第三位的恶性肿瘤,在北京、上海等发达地区已成为发病率第二位的恶性肿瘤。肠癌一期五年生存率高达95%,但肠癌四期的五年生存率仅剩8%。
某种意义上讲,“防”比“治”更重要。邹鸿志分析,“美国肠癌患者之所以生存率高,最主要的原因不是治疗方法多么先进,而是前期预防和筛查到位。”
目前临床上可以通过便潜血、肠镜进行筛查,但便潜血检测的效能不够高,肠镜同样存在预约难、需要服用泻药、空腹时间长、肠镜痛苦、患者体验差等问题,加上中国内镜医生资源的缺乏造成肠癌筛查普及度低。而对于60岁以上的老年人,有些身体状况很难承受肠镜,而这部分人群往往是结直肠癌的高发人群。
也正因如此,许多肠癌患者查出病症的时候已经是中晚期,错过了最佳的治疗时机。医生和患者都迫切期待一种既简单,敏感度、特异度又高的肠癌早诊产品。
多年临床研发,邹鸿志发现,粪便DNA检测对于检测肠道肿瘤具有天然的优势,肠道肿瘤患者的粪便中会含有大量的从肠道肿瘤表面脱落的携带了病变信息的细胞和细胞成分,这些信息可以由特殊的检测手段来解读,具体来说是检测基因的甲基化。
“长安心”正是一款针对中国人开发的,可以准确解读粪便中基因异常改变的大肠癌检测工具,它可以帮助将肠癌阻断在早期阶段,从而达到预防和根治肠癌的目的。
“这个产品最大的特点就是检测准确性高,尤其是对一期、二期的肠癌。在多中心临床试验中,对1213 例有效病例进行统计分析,结果表明本试剂盒对结直肠癌样本的检测敏感性为84.22%(315/374),特异性为97.85%(821/839),总符合率为93.65%(1136/1213)。这个准确率是很高的。” 邹鸿志对投资界透露。
据了解,“长安心”产品取样也很方便,居家使用只需5-10分钟,顺丰寄回,7个工作日内即可得知检测结果。值得一提的是,国内的定价是美国的三分之一左右。
除了“长安心”之外,康立明生物还在拓展产品线,开发肺癌和膀胱癌等肿瘤的早期诊断产品,并已取得阶段性成果。
拿下近4亿融资,鼎晖、IDG押重注
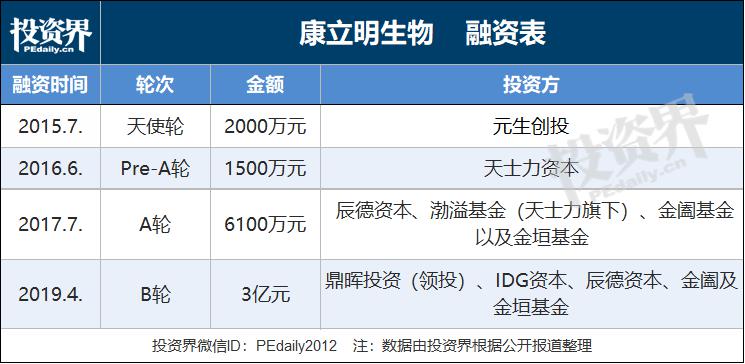
2015年成立至今,康立明生物完成4轮融资,总额近4亿人民币,基本保持一年融一轮的节奏。元生创投在最早期进入,天士力资本以及旗下渤溢基金连投两轮,金域医学关联基金-金阖、金垣基金也在A轮后继续跟投。更为关键是,B轮引入鼎晖、IDG两家知名投资机构,意义重大。
邹鸿志在接受投资界采访时坦言,在其回国创业的四年里,资本扮演了重要角色。
康立明生物在2015年7月拿到第一笔风投,当时是2000万,在此基础上租用场地,建立了公司实体,业务由此展开。
2016年6月,在产品慢慢定型的过程中,邹鸿志拿到第二笔资金。“考虑到公司在产品开发过程中不需要那么多资金,只向天士力资本融了1500万,其实我们可以融得更多。”
2017年,当产品完全做好各种临床测试,要开始进行临床试验时,邹鸿志融了第三笔钱。而如今,当公司拿到第一个粪便DNA检测的国家注册证之际,邹鸿志接受了鼎晖和IDG的投资。
“自从去年拿到注册证前后,有非常多的机构找到我。大概见了7、8家顶级投资机构之后,我们就确定了鼎晖和IDG,大部分投资机构我都没见。”邹鸿志对投资界坦陈,“这两家机构在尽调之前做了非常深入细致的研究工作,并且对接很多的资源给我们,包括销售的途径、政府资源等。”
事实上,鼎晖在肿瘤领域的投资布局深耕已久,行业资源也着实丰富。鼎晖投资创始合伙人王霖介绍,在传统的肿瘤药领域,鼎晖投资了以肿瘤仿制药研发、生产为主的迈博泰科。在癌症治疗领域,鼎晖布局了天境生物、科望生物等肿瘤免疫药物为主的创新药公司。
除此之外,鼎晖关注肿瘤治疗领域新技术的发展,如以双抗平台为基础的友芝友,以CAR-T为工具的斯丹赛和以放射性树脂微球为武器治疗肝癌的Sirtex。围绕癌症的治疗领域,鼎晖同步布局了其上游为新药研发筛选提供服务的和铂医药和先导药业,以及下游为医生癌症组织病理诊断提供试剂服务的迈新生物,达到肿瘤上下游领域的全覆盖。
IDG资本合伙人杨飞也表示,对康立明生物的投资是IDG非常慎重的决定。他认为,目前肠癌高发的现状与国家政策的重视使肠癌早筛成为备受投资界关注的巨大市场,可靠的产品是决战市场的前提。此时投资康立明生物,就是看准其是一家具备巨大潜力的高科技公司。
当然在融资之外,邹鸿志也表达了对资本市场的期待,“我们有明确的上市计划,希望发展成为中国资本市场上癌症诊断检测领域的龙头企业。”






